医科2024.02.17 講演
[保険診療のてびき]
アルツハイマー病の早期診断と対応 -疾患修飾薬の登場を見据えて-
(2024年2月17日)
兵庫医科大学病院 脳神経内科教授 武田 正中先生講演
はじめに
わが国の認知症患者数は2040年に約584万人になると予想される。認知症の原因疾患はアルツハイマー病(AD)が最も多く5~7割を占める。高齢者の約4人に1人は認知症もしくは軽度認知障害(MCI)であり、7人に1人は認知症の計算になる。さらに、その患者数は今後も急速に増加することが予想される。認知症の原因疾患として、ADは5~7割を占めるとされ、早期ADの診断法および疾患修飾薬(根本的治療薬)の開発は喫緊の課題であった。このような状況のなか、2023年9月ADの疾患修飾薬として、抗アミロイドβ抗体医薬がわが国で承認され、12月末より保険収載された。MCIと早期ADが対象で、ADの進行抑制が期待される。この疾患修飾薬の使用にはADの診断バイオマーカー、つまり治療標的分子(アミロイドβ)の存在を確認することが必須である。
一般的に、ADの診断は、臨床症状、経過、認知機能検査、脳MRIや脳血流シンチグラフィ検査等で行われている。疾患修飾薬の登場を踏まえて、アミロイドPET、脳脊髄液や血液の体液バイオマーカーの開発が進んでおり、臨床や研究に使用されている。ADの早期診断バイオマーカーや新しい疾患修飾薬の登場についての話題を取り上げ解説する。
ADの病態および早期診断バイオマーカー
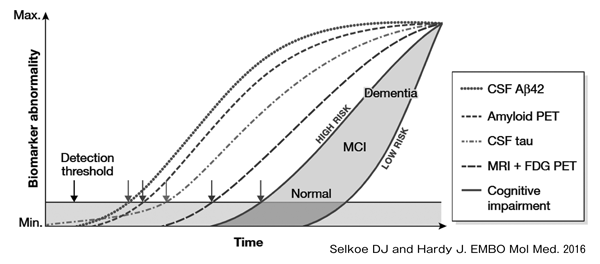
ADによる認知症を発症する場合、脳内病変は約20~25年前から始まっているとされる。最初に出現するのは脳脊髄液アミロイドβ42低下、すぐ後にアミロイドPET陽性である。続いて脳脊髄液タウの上昇を認め、その後に、海馬萎縮や側頭葉および頭頂葉の代謝・血流の低下、そして記憶障害や認知機能障害が出現する(図1)1)。2018年NIA/AAによる臨床試験の診断基準2)で、アミロイドβ蓄積(A)、リン酸化タウ蓄積(T)と神経変性・損傷(N)の3段階に分けて診断することを提唱している。このように、認知症や軽度認知障害は臨床症状によって定義されるが、その原因となるADは臨床症状ではなく病理診断かバイオマーカーで定義される。
ADの診断バイオマーカーは、特徴的な病理的変化である老人斑と神経原線維変化を構成するアミロイドβ蛋白とタウ蛋白が最も重要である。体液バイオマーカーでは、髄液アミロイドβ42低下およびリン酸化タウ上昇がADの診断マーカーとして推奨される。これらのバイオマーカーでは髄液リン酸化タウ測定のみ保険適用であった。
このたび、疾患修飾薬が可能となり、抗アミロイド療法の適応確認の目的で、髄液アミロイドβ測定が保険収載された。また、髄液に比較し、血液マーカーは侵襲が低く汎用性があり、開発が進んでいる。少量の血液からアミロイドβを測定できる機器も研究が進んできており、今後は、汎用性の高い血液検査により、より効率的な方法がなされていくことが期待される。
髄液アミロイドβ測定と同時に、同じ目的でアミロイドPET検査も保険適用となった。厚生労働省の定める最適使用推進ガイドラインに沿って、レカネマブ治療の適応か否かの判断目的でアミロイドβ病理を確認する場合に算定される。
ADの新しい治療
これまでのAD認知症に対する保険適用薬は、コリンエステラーゼ阻害薬4剤とNMDA受容体拮抗薬1剤であった。しかし、これらは効果が限定的で、根本的薬物治療が待ち望まれていた。2023年9月、レカネマブが、「ADによるMCIおよび軽度認知症の進行抑制」の効能・効果で厚生労働省により承認され、12月に薬価が決まりレカネマブを投与することが可能になった。ガイドライン3)ではMCIから初期AD患者が適応で、MMSE22点以上、CDR(Clinical Dementia Rating)0.5から1であることが要件である。レカネマブは、主にアミロイドβ凝集体のプロトフィブリルに結合し、脳内アミロイドβを減少させる4)。1795人の臨床第3相試験では、2週間に1度、18カ月間のレカネマブの投与により、プラセボに比し、アミロイドβが減少し、認知機能の全般臨床症状悪化が27%抑制された5)。
しかしながら、安全性やリスクの問題も指摘されている。副作用としては、アミロイド関連画像異常ARIA(ARIA-Eは浮腫・滲出液貯留、ARIA-Hは脳出血・ヘモジデリン沈着)がある。ARIAは治療の初期に見られることが多いため、MRI検査を治療開始前と治療中に定期的に行う必要がある。ARIAを認めれば、状態を見ながら治療を継続するかどうかを判断する。また、APOE遺伝子ε4型ホモ接合体の場合にARIA発症率が高くなる。治療前MRI所見で、微小出血など脳血管に病変がある場合も、発症率が高くなる。
このような場合には、副作用のリスクを考え、レカネマブを使用するか否かを含め慎重に判断する必要がある。また、レカネマブを投与しても、認知機能が改善する、もしくは低下が止まるわけではない、ことを留意する必要がある。
終わりに
最後に、レカネマブ治療の適応外患者の早期絶望につながらないような対応が必要である。認知症でない方、認知症がADによるものでない方、認知症の重症度が高い方、2週間に1回の通院が無理な方等に対して、ピアサポート、カフェ、心理サポートなどが必要になってくると思われる。また、新たな抗アミロイド治療薬の登場も予定されており、今後さらに有効で、副作用の少ない治療薬の登場が期待される。
参考文献
1)Selkoe DJ. and Hardy J. EMBO Mol Med. 8:595-608, 2016
2)Jack CR Jr. et al. Alzheimers Dement. 14:535-562, 2018
3)レカネマブ(遺伝子組換え)製剤の最適使用推進ガイドライン(2023年12月厚生労働省).
4)Ono K. et al. Int J Mol Sci. 21:952, 2020
5)VanDyck CH. Et al. N Engl J Med. 388:9-21, 2023
(2024年2月17日、神戸支部研究会より、講師肩書きは講演当時のもの)
図1 ADの病理経過