歯科2021.05.30 講演
歯科定例研究会より
歯周再生療法を成功に導くテクニックとストラテジー(2021年5月30日)
京都市・医療法人泰歯会 四条烏丸歯科クリニック 尾野 誠先生講演
ひとくちに歯周治療と言っても、非外科治療に始まり、切除療法、再生療法など、さまざまなアプローチが存在します。中でも再生療法は、歯周病により失われた歯周組織を再生させる、すなわち、そこにないものを増やす治療という性質上、不確定な要素を含み、患者に勧めにくい治療の一つであるかもしれません。歯周再生療法の原理、歴史、手技や材料の変遷を知ることは、これらの不確定要素を減らす一助となると考え、本稿ではそれらについて簡単に述べたいと思います。
歯周再生療法の発祥
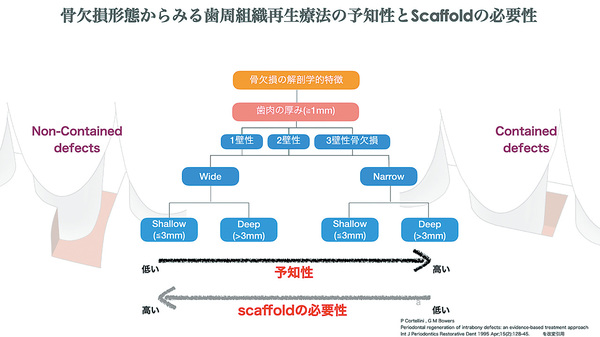
歯周再生療法が行われるようになったのは1950年頃です。それまでは、比較的浅い垂直性骨欠損は切除療法で対応されており、深い垂直性骨欠損は戦略的に抜歯されていました。切除療法がポケット除去の主流を占めていたそのような時代に、Goldman(1949)らは骨内欠損の再生の可能性を示しました(図1)。歯周炎によって生じた垂直性骨欠損(骨内欠損)を1壁性、2壁性、3壁性に分類し、2・3壁性の深くて狭い骨欠損やクレーターにおいてはフラップ手術で病変を廓清して血餅を保持することで、ある程度骨の再生が生じることを示しました(図2)。
川崎(2014)も、1960年代に行ったフラップ手術で垂直性骨欠損の再生が生じた症例を報告しています。Prichard(1957)は、さらに積極的な骨再生の手法としてBone Denudation Techniqueを発表しました。骨欠損部上の上皮を排除して骨欠損部を露出させることで上皮の深部増殖を遅らせ、骨からの細胞の遊走を優先させるという方法です。しかし、この手法は第2大臼歯遠心部の垂直性骨欠損など、かなり限定しされた部位に適応されるため、現在臨床で応用されることはほとんどありません。
自家骨移植術の考案
その後、自家骨移植術 (Nabers、1965)、脱灰凍結乾燥他家骨(Urist、1965)、腸骨移植(Schallhorn、1967)など、骨移植を用いた再生療法が相次いで考案されました。自家骨移植術は外部からの感染のリスクがなく、骨移植材料のゴールドスタンダードとして比較的長く臨床応用されていますが、移植骨採取に関わる外科的侵襲や量的制限などの欠点があります。また、上皮の深部増殖により「修復」という治癒様式となることも報告されています。
脱灰凍結乾燥他家骨は、Bowersら(1985,1989)によって、ヒトでの組織学的評価で高い頻度で再生が生じていることが示されました。その後、GTR法やEMDと併用され、良好な結果が報告されています。脱灰凍結乾燥他家骨は50年以上前から臨床応用されており、感染などの問題は報告されておらず、簡便・安全・効果的な材料と言えます。脱灰凍結乾燥他家骨の骨再生能には、骨に含まれるBone Morphogenic Protein(BMP)が関与していることが報告され(Urist、1971)、BMPの開発が始まりました。その開発には長い時間を要しましたが、2000年頃に商品化され、歯槽骨造成などで臨床応用されていますが、歯周組織再生に使われることはほとんどないようです。
一方、Catonら(1993)は垂直性骨欠損部に自家骨移植を行い、歯槽骨の再生が認められたケースの組織学的評価を行ったところ、新生骨と根面との間に上皮細胞の深部増殖が認められたことを報告しています。すなわち、骨欠損部への上皮細胞の深部増殖をいかに阻止できるかが、歯周組織再生の一つのポイントとなります。
PrichardのBone Denudation Techniqueは、骨欠損部への上皮の深部増殖を阻止する方法の一つとして考えることができます。Ellegaardら(1974,1976)は、垂直性骨欠損部に遊離歯肉移植片(Free Gingival Graft:FGG)を行うことで歯槽骨が再生することを示しました。骨欠損をFGGで被覆すると骨欠損部内の血餅は結合組織で被覆されますが、移植片の上皮組織は一時的に壊死を起こし、上皮細胞の深部増殖は遅延して歯槽骨の再生が生じると報告しています。また、Kramer(1992)は、垂直性骨欠損部に骨移植を行い、フラップの上皮をフェノールで定期的に焼灼することで術後の上皮の深部増殖を防ぐ方法を報告しています。
これらの手法を現在、意図的に用いることはありませんが、一次治癒を目指した手術が壊死を起こした際の治癒経過と同様といえます。つまり、フラップの壊死により上皮の増殖が一時的に阻害され、その間にその他の組織が成熟する可能性があるため、創面の裂開や壊死は必ずしも再生療法が失敗に終わることを意味しません。
GTR法の発表
その他、上皮の深部増殖を確実に阻止する方法としては、組織誘導再生療法(Guided Tissue Regeneration:GTR法)があります。これはMelcher(1976)の仮説に基づいており、「歯周外科手術後の治癒において(1)歯肉上皮、(2)歯根膜線維、(3)セメント質、(4)歯槽骨の四つの異なった組織から遊走した細胞が根面上で競合する。根面上に付着する細胞によって付着様式や再生が決定される」という仮説です。
Nyman,Karringら(1982)は、ミリポアフィルターというバリア膜を用いて骨欠損部と上皮との間に隔壁を作ることにより、歯根膜、セメント質、歯槽骨由来の細胞のみが増殖する環境を作ることで、歯周組織再生をより確実なものにしました。その後、Gottlowら(1984)によって、Gore-Tex膜というバリア膜が開発され、臨床応用されるに至りました。
GTR法の発表は、当時の世界の歯科界に大きな衝撃を与え、多くの歯周病専門医がこぞってGTR法で良好な結果を発表することになりました。上皮の深部増殖を確実に防止できる方法として、再生療法の成功率が飛躍的に向上しました。1980年代後半から2000年頃まで多くの臨床家によって良好な結果が数多く発表されています。ShallhornとMcClainら(1993)やAndereggら(1991)は、 Gore-Tex膜と脱灰凍結乾燥他家骨の併用法は膜単独での結果より有意に再生量が大きく、長期的にも安定していることを示しました。
その一方で、治療技術が難しいことや、膜の露出、歯肉弁の壊死、術中の感染などの術後併発症の報告も多く、1990年代後半にEnamel Matrix Derivertives(EMD)の臨床応用が開始されてから、歯周再生療法におけるGTR膜の使用は激減することになりました。
セメント質再生の研究
歯槽骨の再生や上皮の深部増殖のコントロールに着目した研究が進む一方で、セメント質の再生の研究も進んでいました。1976年に始まったSlavkinらの一連の研究により、歯根形成期においてヘルトヴィッヒ上皮鞘から分泌されるエナメル基質タンパクが未分化間葉系細胞を刺激し、セメント芽細胞への分化を促進していることが解明されました。そして、根面上に沈着したエナメル基質タンパクはセメント質、歯槽骨、そしてその間をつなぐ結合組織線維の発生を誘導すると考えられました。すなわち、EMDを用いた歯周組織再生療法は、歯根の形成期に生じる歯周組織の発生過程を模倣した治療法ということができます。
2017年Murakamiらは、塩基性線維芽細胞増殖因子(basic fibroblast growth factor:FGF-2)を歯周組織再生材料として開発し、商品化されました。まだ、長期的な結果はありませんが、筆者も臨床応用を慎重に行い、EMDとの材料の特性や効果などを比較、その有効性を確認しています。
(5月30日、歯科定例研究会より、小見出しは編集部)